EL LABORATORIO EN EL PACIENTE HIV.
Ver: Introducción a Biología Molecular
El síndrome de inmunodeficiencia adquirida (SIDA) es la manifestación
más grave de un espectro clínico de enfermedades que sigue
a la infección por el Retrovirus de la inmunodeficiencia humana
(HIV). Se define por el desarrollo de infecciones oportunistas graves,
neoplasias u otras manifestaciones potencialmente fatales resultantes
de la inmunosupresión progresiva inducida por el HIV.(1)
El HIV se transmite a través del contacto sexual, drogadependencia
endovenosas, transfusión de sangre y derivados y la transferencia
madre –feto y madre –hijo.
El HIV es un Retrovirus linfotrópico que infecta primariamente
y destruye los linfocitos
CD 4 + (linfocitos T helper). (1)
Estas células son cruciales para la inducción y regulación
de la respuesta inmune. Su depleción progresiva por el virus causa
una falla en la función inmune normal conduciendo a la inmunosupresión
y subsecuente desarrollo a SIDA, con la aparición de infecciones
oportunistas.(2)
El laboratorio en la estrategia de control de la infección por
HIV, constituye hoy día una pieza fundamental, ya que posibilita
su diagnóstico y permite reducir a un mínimo la transmisión
transfusional. (3)
El HIV por su naturaleza RNA virus es altamente mutable, generando variantes
viables y constituyendo un virus altamente elusivo al tratamiento.
Actualmente gracias a los aportes de la Biología Molecular se logró
secuenciar el genoma viral, establecer mutaciones y deleciones en el mismo
tendiente a lograr, si no una eliminación completa del virus, una
disminución del virus circulante para minimizar sus efectos en
el huésped. (3)
ASPECTOS VIROLOGICOS DEL HIV
DESCRIPCIÓN DEL VIRUS
El HIV pertenece a la familia Retroviridae, subfamilia Lentiviridae,
fue descubierto en 1983. Se acepta la existencia de dos tipos de virus:
el HIV-1, ampliamente diseminado en todo el mundo, del cual se han caracterizado
varios subtipos (A, J, M, O) y el HIV-2 con elevada prevalencia en Africa
Occidental, cuyo genoma coincide con el HIV-1 en un 40-50%.
El virus del HIV es una partícula esférica, constituido
por una envoltura proveniente de la membrana externa de la célula
huésped, en la que están incluidas numerosas espículas
formadas por dos glicoproteínas: la gp120 (más externa)
y la gp41 (de transmembrana). Debajo de la envoltura se encuentra la cáspside,
de simetría icosaédrica constituida por la proteína
p17. (3)
Dentro de la cáspside se encuentra el core de forma conoide y estructura
proteica (proteína p24) que contiene al nucleoide constituido por
dos cadenas de ARN monocatenario íntimamente relacionadas con las
proteína p9 y p7 y la enzimas integrasa, proteasa y transcriptasa
reversa. (4)
El genoma de HIV está constituido por dos secuencias terminales
repetitivas largas (RTL) los genes env, gag y pol (genes estructurales
comunes a todos los retrovirus) y una serie de genes reguladores (tat,
rev, nef, vif, vpu, vpr, vpx) que interviene en la replicación
viral.
El gen nef al principio se definió como un regulador viral negativo
pero posteriormente se demostró que regula en mas la expresión
viral en ciertas circunstancia. (5)
CICLO REPLICATIVO DEL VIRUS
El paso fundamental en la infección por HIV es la fijación de la proteína gp120 al receptor celular CD4, proceso muy específico y eficiente ya que la afinidad de aquella por la molécula CD4 es mayor que la afinidad por la molécula del Complejo Mayor de Histocompatibilidad (MHC) clase II. Es decir, el CD4 actúa como receptor primario para el HIV, el cual se expresa en: Linfocito T CD4+ y células del linaje monocítico-macrofágico. También infecta otros tipos celulares que expresan cantidades variables de CD4 o incluso que carecen de una expresión detectable: megacariocitos, células dendríticas, células epidérmicas de Langerhans, astrocitos, oligodendroglia y microglia, células CD8+, del cuello uterino, rectales, trofoblásticas, renales miosíticas y retinianas. (1),(3)
Trabajos recientes indican la existencia de por los menos dos co-receptores que median en el proceso de fusión. Estos mediadores se describen como receptores para citoquinas. El mayor co-receptor para la cepas macrófago trópicas de HIV (M-tropic o cepa R5) es el receptor para las beta quimoquinas 5 (CCR5), mientras que el CXCR4 lo es para las cepas Linfocito T trópicas (LT tropic o cepas X4). Se encontró que individuos infectados sanos HIV positivos poseen una resistencia innata a la infección. Esto ha instado a investigar las variantes genéticas de individuos negativos pertenecientes a grupos de alto riesgo de infección por HIV que carecerían de los receptores de la beta quimoquinas. El mecanismo protectivo del polimorfismo génico de CCR5 esta asociado a la modulación de su expresión en la superficie de las células blanco. (6)
Después de la fijación, el virus se fusiona con la membrana
celular y es internalizado en una reacción poco conocida que parece
involucrar a la proteína gp41.
Después de la internalización y la pérdida del revestimiento
viral, la enzima viral transcriptasa reversa (RT) transcribe el RNA viral
en DNA bicatenario que puede circular como episoma y no integrarse, o
a través de la acción de la enzima integrasa ,puede ser
integrado como provirus en el DNA celular. Cuando la célula infectada
es activada posteriormente, se transcribe el DNA proviral con producción
de RNA, síntesis y procesamiento de proteínas, ensamble
del virus y gemación de la célula.
La activación celular es importante en la expresión del
HIV. Distintas señales activadores entre ellas antígenos,
virus heterólogos y citoquinas son capaces de aumentar la expresión
viral de células crónicamente infectadas. La estimulación
de las células T activa varios factores de transcripción,
incluido el factor de transcripción celular NF-KB, que luego inducen
la transcripción de genes específicos involucrados en la
respuesta de las células T.(6)
DINAMICA VIRAL
La cantidad de virus circulante es el resultado de un equilibrio dinámico entre producción del HIV en el tejido linfático y su neutralización por parte del sistema inmunológico. Se estiman que se producen y se destruyen (clearence viral) 1010 partículas vírales diariamente en un individuo infectado, esto significa que la mitad de los virus circulantes son recambiado cada día, por lo tanto la vida media del HIV en plasma es de 24-48 horas. Esta masiva producción de virus va acompañada de la destrucción y remplazo de casi dos millones de células CD 4 + por día. (7)
DIVERSIDAD GENÉTICA
La dinámica de la replicación del HIV tiene grandes implicancias
en la generación de una diversidad genética (cuasi especies)
dentro de un mismo individuo. Cultivos de virus aislados de pacientes
con infección reciente, presentan una baja tasa de heterogeneidad
genética, mientras que los aislados de pacientes con un tiempo
de infección más prolongado, demuestran una gran diversidad.
Esto se debe a la cinética de replicación y a la capacidad
de mutación que tiene la transcriptasa reversa frente a la respuesta
inmune del huésped. (7)
La mayor parte de estas mutaciones ocurren en el gen de la envoltura y
se ha demostrado en las proteínas de la envoltura que estas diferencias
determinan una capacidad citopática del virus. Además las
diferencias en la capacidad de las cepas variantes de HIV para infectar
células T primaria o monocitos macrófagos in vitro parecen
deberse a cambios en la región de la envoltura. (1)
El rápido recambio provee el mecanismo idea para la producción
de mutaciones s que permite escapar del control inmunológico de
la infección o que confieren resistencia a drogas. Cuando las drogas
que inhiben la replicación son administradas inapropiada mente,
genera una presión selectiva en la evolución hacia cepas
resistentes. Existen cepas que crecen preferentemente en macrófagos
y no forman sincitios celulares (HIV-NSI) de menor patogenicidad. En fase
más tardía de la enfermedad se detectan más variantes
citopática de HIV que crecen bien en las células T. Estos
aislamientos se identifican como cepas inductoras de sincitios (HIV-SI),
más citotóxicas, responsables de la declinación aceleradas
de células T CD4 +. (13)
ANOMALÍAS DE CELULAS T
Después de la infección los linfocitos T CD4+ totales caen
en forma precipitada coincidiendo con el pico de viremia, así mismo
los signos y síntomas se asocian con un síndrome viral agudo.
A medida que la viremia se resuelve, las células T CD4 + totales
pueden elevarse hasta niveles casi normales. Durante el período
de latencia clínica (que puede durar hasta 10 años) los
niveles de CD4+ declinan a ritmo que varía en los distintos individuos.
Se han postulado distintos mecanismos para explicar la depleción
de células T CD4+:
a) Infección directa con citopaticidad
b) Destrucción indirecta de células T
c) Incapacidad para regenerar células T madura
d) Autoinmunidad
ALTERACIONES FUNCIONALES DE LAS CÉLULAS CD4 +
Los individuos HIV + asintomáticas son anérgicos en las
reacciones cutáneas de hipersensibilidad retardada (por ejemplo
una reacción de PPD puede dar negativa.)
Otro trastorno funcional de las células T comprende un desequilibrio
entre las células T helper 1 y 2 y las citoquinas que producen.
Ambos subgrupos activan la inmunidad celular y humoral respectivamente.
Existe un desequilibrio entre funcionamiento de esos dos subgrupos y haciéndose
predominante el subgrupo de las células T helper 2 durante la progresión
de la enfermedad.(8)
ANOMALÍAS EN LAS CÉLULAS T CD8+
Estas células se encuentran disminuidas en el periodo agudo de
la infección por HIV. En 3 o 4 semanas el recuento de las mismas
retorna a la normalidad o supera los niveles normales.
Los enfermos de SIDA con infecciones oportunistas y células T CD4
disminuidas generalmente presentan una disminución de células
T CD8, lo cual podría reflejar una pérdida de la capacidad
de las células progenitoras para generar nuevamente células
T maduras.
CITOQUINAS
Las células B de los individuos infectados por HIV secretan factor
de necrosis tumoral (TNF- alfa) e interleuquina IL-6, esto es importante
en el medio ambiente del ganglio linfático donde las células
T CD4+ infectadas que migran, encuentran un medio permisivo de citoquinas
que sostiene la replicación viral activa. (1)
DIAGNOSTICO DE INFECCION POR HIV
Existen métodos directos e indirectos de laboratorio para la detección
de HIV. Los métodos directos detectan la presencia del virus completo,
sus proteínas o sus componentes genéticos. Estos incluyen
ensayos de captura del antígeno p24, cultivo viral y PCR.
Los métodos indirectos detectan la presencia de anticuerpos, incluyendo
ensayos de screening o tamizaje y pruebas suplementarias o confirmatorias.(9)
MÉTODOS DIRECTOS
Se utilizan para resolver situaciones donde la serología no permite llegar a un diagnóstico definitivo. Están indicados para:
- · Pacientes que han tenido contacto reciente con personas HIV confirmadas o en accidentes laborales.
- · Evaluación de la evolución de la enfermedad.
- · Individuos con sintomatología sospechosa no confirmada por la presencia de anticuerpos (serología indeterminada).
- · Confirma la infección en niños nacidos de madres HIV positivas.
Determinación de Antígeno p24
Marcador diagnóstico de infección primaria por HIV. Es una
proteína viral que se cuantifica por el método de disociación
de inmunocomplejos (DIC), el cual consiste en la disociación ácida
o alcalina de los inmunocomplejos aumentando la sensibilidad de la prueba.
Los niveles aumentan rápidamente luego de la infección aguda
y declinan haciéndose indetectables para esta prueba.
En adultos es detectado con anterioridad a la seroconversión, también
en etapas tardías de la enfermedad. La detección de Ag.
p24 en suero aumenta el riesgo de progresión a la enfermedad.
En pediatría dos muestras tomadas en tiempos diferentes y positivas
para Ag. p24 establecer el diagnóstico de infección.
La detección de Ag. p24 no tiene una estrecha relación con
la determinación de carga viral y existen varios factores que influirían
en la variabilidad de estos marcadores subrogantes.
Una resultado de carga viral alta y niveles bajos de Ag. p24 pueden ser
debidos a un RNA defectivo y que no se expresa en proteína p24.
(10)
Cultivo viral
Se usa como marcador pronóstico de la infección por
HIV, generalmente la determinación de la infección se realiza
midiendo Ag. p24 en el sobrenadante de cultivo celular. Se utilizan líneas
celulares T o linfocitos frescos de cordón umbilical. El cultivo
celular debe ser estimulado por mitógenos e interleuquinas 2.(11)
Reacción en cadena en la polimerasa (PCR)
Constituye una técnica altamente sensible que logra detectar
hasta una copia de ADN viral o provirus, mediante amplificación
de un segmento seleccionado del provirus presente en el ADN de las células
infectadas por HIV-1.Especialmente utilizada para realizar el diagnóstico
precoz de infecciones por el HIV-1 en niños menores de 18 meses
de edad y se puede lograr una sensibilidad y especificidad del 100%.(12)
TMA: (Transcription Mediated Amplification ) determina la presencia
del virus de la hepatitis C consta de tres etapas:
1) preparación de las muestra donde se libera en material genético
de la partícula viral y se separa por hibridación sobre
una partícula magnética
2) TMA donde se da la amplificación isotérmica del RNA con
un intermediario de DNA doble hebra
3) detección hibridación con sondas marcadas con ester de
acridina y posterior oxidación que genera una señal tipo
flash para el control interno y una señal “lenta”para
el material genético de la muestra..tiene una sensibilidad de 5
IU/ml .es 10 veces mas sensible que las técnicas de PCR.
MÉTODOS INDIRECTOS
La producción de anticuerpos generalmente es detectable 4 - 12
semanas después de la infección y continúa en el
tiempo. Esto es estimulado por la persistencia del virus, aún cuando
se encuentre restringido al sistema retículo endotelial por años.
(11)
Se clasifican en:
· Pruebas de tamizaje
· Pruebas confirmatorias
Pruebas de tamizaje: Son técnicas de gran sensibilidad que permiten
la pesquisa de individuos infectados, pudiendo generar resultados falsos
positivos, por lo tanto no se utilizan como diagnóstico definitivo.(3)
Enzimoinmunoensayo (ELISA)
Estas técnicas utilizan soportes en fase sólida (policubetas,
membranas, perlas) sobre los cuales se absorben varias formas de los antígenos
de HIV (lisado viral, proteínas vírales purificadas o recombinantes,
péptidos sintéticos). Los que utilizan lisado viral contienen
un numeroso y amplio rango de sitios antigénicos, que representan
la mayoría de las proteínas del HIV. Esto asegura la detección
de anticuerpos contra diferentes subtipos de HIV y reduce la posibilidad
de perder variantes, pero compromete la especificidad del ensayo, dando
lugar a resultados falsos positivos. Sueros conteniendo anticuerpos que
reconocen un epitopes, compartido por HIV y otros virus o bacterias, o
anticuerpos que unen antígenos leucocitarios humanos y otros componentes
de la célula del huésped presentes en lisado, son falsamente
reactivos. Esta reactividad se evita usando proteínas recombinantes
o péptido sintético como fuente de antígeno. De todas
maneras los péptidos recombinantes pueden contener contaminantes
(proteínas de bacterias o levaduras) e incluso restos antigénicos,
provenientes de las proteína de fusión, que causen algunos
resultados falsos positivos. En síntesis, los péptidos recombinantes
permiten un aumento de sensibilidad y pronta detección de la seroconversión.
En los ELISA de última generación el conjugado es el antígeno
viral, con lo cual se acorta el período de ventana serológica
debido a la posibilidad de detectar distintas clases de inmunoglobulinas.(3)
Pruebas de aglutinación
Los antígenos vírales son unidos a micropartículas
que pueden ser de distinto material (de látex, gelatina, sintéticas
o glóbulos rojos). La sensibilidad de esta técnica es similar
al ELISA.(3)
Inmunodot
Los antígenos vírales son recombinantes o sintéticos
y se encuentran unidos a una membrana de nitrocelulosa dentro de un contenedor
plástico.(3)
PRUEBAS CONFIRMATORIAS
En algunas ocasiones otros anticuerpos de distinto origen del HIV pueden
dar reacción cruzada en las pruebas de screening. Un resultado
positivo debe ser confirmado por uno o más métodos alternativos.
Los tres métodos que han sido aprobados son los siguientes:
Western-blot (WB)
Detecta anticuerpos contra HIV usando enzimas conjugadas a anticuerpos
anti-inmunoglobulina humana y proteínas de HIV inmovilizadas en
fase sólida. Las proteínas son previamente separadas electroforéticamente
y luego transferidas a membranas de nitrocelulosa sobre las que se efectúa
un ELISA indirecto. La intensidad de cada banda se evalúa visualmente
comparándola con una tira control que exhibe todas las proteínas
principales. El resultado de WB se interpreta como positivo, indeterminado
o negativo sobre la base del número y tipo de bandas observadas
en cada tira. Se han establecido diferentes criterios de interpretación
por distintas organizaciones.(11)(2)
El criterio utilizado en nuestro laboratorio es el de la ASTPHLD (Association
of State and Territorial Public Healdth Laboratory Directors ) y el del
Center Disease Control (CDC) que establece:
WB positivo: Cuando presenta por lo menos dos de las siguientes bandas
p24, gp41, gp120/gp160.
WB negativo: Ausencia total de bandas.
WB indeterminado: Presencia de cualquier banda sin que se cumpla el criterio
de positividad (3). Este resultado puede resolverse por PCR o repitiendo
el WB en 3-6 meses. El CDC recomienda considerar como negativo un resultado
WB indeterminado estable por lo menos por 6 meses en un individuo asintomático.
(11)(3)
MARCADORES SUBROGANTES
Los marcadores virológicos e inmunológicos adquieren un
rol primordial en el monitoreo de la progresión de la enfermedad
y de la respuesta al tratamiento antirretroviral. Estos marcadores son
importantes para determinar el pronóstico y la mejor estrategia
a seguir en cada paciente.
Un número de diferentes marcadores, también llamados marcadores
subrogantes tales como recuento de CD4+, beta 2 microglobulina, neopterina,
antígeno p24 con disociación de inmunocomplejos (ICD) ,
formación de sincitios (SI vs NSI) han sido utilizados como alternativa.
Pero existe consenso que la medición por métodos moleculares
del HIV - RNA es mejor para monitorear la infección por HIV. (10)
Recuento de linfocitos CD4+
Es el marcador más sensible para establecer el daño inmunológico
que caracteriza la enfermedad, sin embargo no es suficiente para establecer
el riesgo de progresión de enfermedad. Cuando el recuento es mayor
de 500/mm3, existe muy poca probabilidad de desarrollar la
enfermedad. Existen limitaciones como:
1) Variaciones del laboratorio en las mediciones de CD4+, además
de las fluctuaciones debidas a: ejercicio físico, momento del día
de la extracción, enfermedades concurrentes menores.
2) Marcada disociación entre la respuesta CD4+ y el desarrollo
clínico. El cambio en el tiempo de los valores absolutos de distintas
mediciones de CD4 es de mayor valor predictivo, es un test subóptimo
para medir la respuesta a antirretrovirales.
3) El conteo de CD4 esta asociado con un mayor grado de variabilidad.
Personas con conteo de CD4 + similares pueden diferir en sus futuros valores,
en la variabilidad de los valores de descenso y en su riesgo de progresión
clínica.
4) El preciso rango normal del conteo de células CD4 + no esta
establecido claramente. Las mediciones de CD4 + muestran variaciones intramuestra.
(10)
Beta 2 microglobulina
Aparece en la superficie de toda célula con núcleo.
Es un débil marcador de progresión y sobrevida en pacientes
con HIV. Se encuentra aumentada durante la activación de los linfocitos,
correlacionándose inversamente con el conteo de CD4+. Su valor
pronóstico es mejor si se lo utiliza en conjunto con el conteo
de CD4. (10)
Neopterina
Marcador de una baja respuesta a la terapia, no es útil para
predecir evolución de la enfermedad. Esta inversamente correlacionada
con el conteo de CD4+. Altos niveles de neopterina sérica están
asociados con un estado avanzado de enfermedad. (10)
Fenotipo Biológico
Marcador de la evolución clínica. Las características
de crecimiento de los aislamientos de HIV luego de un cocultivo de células
mononucleares periféricas, tienen correlación con la virulencia
del virus.
En la línea celular MT-2 los aislamientos producen dos variantes
principales: los formadores de sincicios (SI) y las no formadoras de sincicios
(NSI).
Las SI replican rápidamente y aumentan la probabilidad de selección
de mutaciones resistentes y tienen un marcado tropismo por células
T (linfotróficas) y están asociadas con un aumento del riesgo
de progresión de la enfermedad. La aparición de cepas SI
antes de la aparición del SIDA es un marcador pronóstico
para una rápida declinación de los niveles de CD4 + y subsecuente
progresión a la enfermedad.(10)
Las NSI replican muy lentamente, y tienen tropismo por los macrófagos
(macrofagotróficos). Una cepa NSI puede variar a SI, si ocurre
esto, el tiempo que transcurre hasta la aparición de enfermedades
oportunistas es de 6-8 meses.
Para este marcador existe un grado de variabilidad poco aceptable para
el seguimiento de la evolución clínica. (10)
CARGA VIRAL PARA HIV
La medición de carga viral es una prueba para determinar la cantidad
del virus en plasma, usando una tecnología de reacción en
cadena de la polimerasa (PCR) que permite la amplificación y la
identificación de secuencias específicas de DNA o RNA o
utilizando branched HIV-1 RNA (b-DNA) . Es una tecnología de amplificación
de señal para la cuantificación directa de ácidos
nucleicos virales tal cual circulan fisiológicamente en suero del
paciente infectados ya que no hay amplificación del material genético.
Los ensayos de b-DNA utilizan estándares que son calibrados contra
un gold estándar que es validado por tres métodos analíticos
independientes (espectrofotometría, análisis de fosfato
,hipercromicidad) ,esta designado para cuantificar la carga viral de los
subtipos no B, que su prevalencia esta aumentando en el mundo.
Tiene un valor pronóstico que permite su utilización para
recomendar el inicio del tratamiento y planear una estrategia terapéutica
para cada paciente.
Esta prueba se realiza según las directrices siguientes:
- a) Para establecer la línea de base se realizan dos cargas vírales.
- b) Los pacientes con enfermedad clínicamente estable, deben pasar por una prueba cada cuatro meses, siempre seguida del conteo de linfocitos CD4.
- c) Cuando se realizan cambios en la terapia, el monitoreo se hace con más frecuencia. La carga viral debe ser monitoreada en la línea de base (obtener dos lecturas con cerca de una semana de intervalo) y luego donde se encuentra el pico máximo de la droga o combinaciones de las drogas (2-12 semanas después de iniciada la terapia).
Los niveles del HIV RNA fluctúan durante el curso de la infección.
(14)
Usar la medición de carga viral para evaluar el tratamiento tiene
ventajas sobre otros marcadores clínicos vírales, ya que:
-Se produce la medición directa del blanco del tratamiento
-Repercusión rápida del efecto del tratamiento o de la pérdida
de su efecto en– 2 a 4 días.
Tiene un beneficio pronóstico adictivo cuando se usa combinado
con el cálculo de las células CD4+.
Los niveles plasmáticos de HIV RNA pueden reflejar replicación
viral activa en el tejido linfoide.
La variabilidad biológica para estos ensayos moleculares es de
0,3 log. Los cambios ocurridos en los niveles de RNA en plasma mayores
de 0,5 log. reflejan cambios en los niveles de replicación viral.
En pediatría la carga viral resulta predictiva del deterioro clínico
después del segundo o tercer mes de vida. (15)
En mujeres embarazadas hay una fuerte asociación entre el número
de copias de HIV RNA y la probabilidad de transmisión de la infección
de madre al niño.
La carga viral no informa del efecto de otras variables pronósticas,
como la resistencia a las drogas y la virulencia del fenotipo viral.
La infección por HIV persiste aunque los niveles de HIV RNA son
indetectables por los métodos corrientes de carga viral. El DNA
proviral es aún detectable en células mononucleares de sangre
periférica y tejido linfoide.
La definición de carga viral indetectable depende del ensayo utilizado.
El tratamiento debe ser iniciado cuando la carga esta entre 5.000-10.000
HIV RNA copias/ml para la técnica de PCR. La medición de
la carga viral se debe hacer a las 4, 16 y 24 semanas. La semana 16 se
usa para evaluar el éxito o falla del tratamiento y tomar una decisión
clínica. El valor de supresión de la carga viral en la semana
24 de tratamiento se correlaciona con la continuación de la supresión
a la semana 40. (16)
Cuando se utiliza carga viral ultrasensible el tiempo para ver el descenso
de la misma es más de 16 semanas. (14)
RESISTENCIA A DROGAS ANTIRRETROVIRALES
La terapia antirretroviral previene la replicación viral a niveles
no detectables y por el mayor tiempo posible. Reduciendo así la
progresión de la enfermedad
Cuando se produce falla en el tratamiento, puede ser debido a:
- · Baja adherencia por el paciente, lo cual lleva a una supresión subóptima de la carga viral y una generación más rápida de resistencia.
- · Resistencia viral codificada genéticamente
- · La presencia de variantes vírales resistentes a las drogas tendrá incidencia en el fracaso de la terapia.
- · Efectos farmacocinéticos y metabólicos de la medicación.
- · Falla inmune del huésped.
La resistencia a una o varias drogas antirretrovirales podría
definirse como cambios que mejoran o incrementan la replicación
viral en presencia de inhibidores. Es el resultado de un fenotipo alterado
por cambios del genotipo viral preexistente que puede medirse tanto in
vitro como in vivo.
Los fenotipos resistentes se determinan teniendo en cuenta la capacidad
de replicación de las cepas vírales en presencia de una
droga comparada con una cepa sensible
La susceptibilidad a la droga es expresada como concentración inhibitoria
50 0 90 (CI 50 o CI 90), es decir la concentración de droga que
inhibe el 50% o el 90% de la replicación viral. (18)
La resistencia a la droga in vivo se ve reflejada en un incremento en
la carga viral y se asocia con el fenotipo y/o genotipo. (18)
METODOLOGÍAS EMPLEADAS EN EL ESTUDIO DE GENOTIPOS RESISTENTES
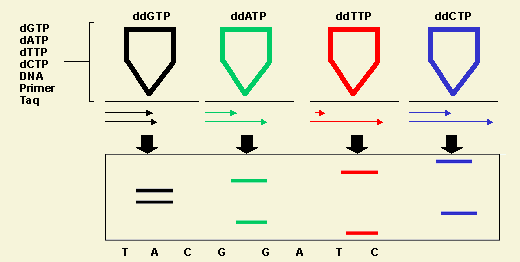
Permiten determinar alteraciones en el genoma viral que pueden resultar
en cambios de la secuencia de aminoácidos de las proteínas
vírales transcriptasa reversa (TR) y proteasa (PV).
La metodologías son dos:
- 1- Ensayos de secuenciación
Proveen información sobre todas las mutaciones presentes en la región genómica analizada y que potencialmente pueden asociarse a resistencia. Hay dos clases de métodos secuenciación cíclica, Hibridación de oligonucleótidos. - 2- Determinación de mutaciones puntuales
Comprenden: PCR en primers específicos y hibridación diferencial (LIPA)
METODOLOGÍA EMPLEADA EN EL ESTUDIO DE FENOTIPO
Este método se basa en realizar el aislamiento del virus a partir
de la sangre de un individuo infectado, amplificarlo y cuantificarlo.
(19)
INFECCIONES OPORTUNISTAS
Con el advenimiento del síndrome de inmunodeficiencia (SIDA) adquirida deben investigarse en estos pacientes microorganismos considerados oportunistas además de los que habitualmente se estudian en los distintos materiales.
INFECCIONES DE LA PIEL
Una de las primeras manifestaciones clínicas de la infección por HIV es la lesión en piel. Esto ocurre por una alteración del sistema inmunológico. En estos pacientes puede además infección sistémica.
1-Bacterias que deben investigarse:
- Bartonella henselae y B. quintana son agente causal de la angiomatosis bacilar y la peliosis bacilar que se manifiesta con lesiones cutáneas y lesiones vasculares subcutáneas Estos microorganismos deben buscarse en muestras de sangre y tejidos.
- Staphylococcus aureus: es el microorganismo causal de la mayoría de las infecciones cutáneas. Las lesiones son del tipo del impétigo, celulitis abscesos.
- Treponema pallidum: Las manifestaciones cutáneas en los pacientes HIV + son atípicas enmascarando el diagnóstico. La serología en estos casos no tiene mucho valor ya que la respuesta inmune se encuentra disminuida.
- Nocardia spp: Son comunes en los pacientes que están severamente comprometidos. La puerta de entrada puede ser la inoculación en la piel. La nocardiosis cutánea se puede subdividir en: micetoma, infección linfocutánea, infección superficial de piel e infección diseminada con involucramiento cutáneo secundario. En Argentina N. brasiliensis es el agente etiológico más común de los actinomicetomas, el cual afecta frecuentemente al pie.
- N farcinica produce una variada de manifestaciones clínicas entre ellas infecciones cutáneas. Es importante diferenciarla debido a la alta resistencia a los antimicrobianos
- Mycobacterium tuberculosis: La tuberculosis cutáneas puede
ocurrir por infección directa de una fuente exógena o
por autoinoculación o diseminación endógena de
otro sitio. Pueden aparecer en el curso de una infección diseminada
o constituir la única evidencia en una lesión de la infección
por micobacterias. La presentación puede ser en forma de máculas,
pápulas o úlceras tanto en el tronco como en las extremidades.
El diagnóstico se realiza por baciloscopía y cultivo de
material obtenido o por biopsias o raspados de las lesiones. Debido
a que la tuberculosis puedes ser multirresistente en pacientes con SIDA
es indispensable determinar la sensibilidad antibiótica. (20)
Mycobacterium avium-intracellulare (MAC): Cuando aparecen las manifestaciones cutáneas es porque la infección se ha diseminado. Siempre esta asociada al SIDA. El diagnóstico se realiza por baciloscopía y cultivo de las lesiones. (21)
2-Agentes vírales que deben investigarse:
- Herpes simple (VHS): Causan lesiones en la piel en pacientes inmunocomprometidos, especialmente HIV+ . En fase temprana de al enfermedad aparece la causadas por VHS siendo autolimitada y en fase más avanzada las manifestaciones cutáneas persisten. El diagnóstico se realiza tomando material de la lesión. El estudio ser realiza por cultivo, IFD, PCR. Los test serológicos no tienen valor
- Molluscum contagiosum: Las lesiones cutáneas se manifiestan generalmente en la cabeza y en cuello en pacientes con recuento de CD4+ <200celulas / mm3.
3-Agentes micóticos .
- Cryptococcus neoformans- Coccidioides inmitis- Hystoplasma capsulatum:
Criptocococis es una de las primeras manifestaciones de la infección
sistémica presentándose en un 5-10 % de los pacientes
con HIV. En los pacientes con enfermedad avanzada se observan lesiones
cutáneas debido a C. inmitis.
La manifestación cutánea de la histoplasmosis diseminadas en pacientes HIV se presenta en forma papular, hemorrágica y úlcero necrótica.
El diagnóstico de las micosis se realiza obteniendo material de la lesión o por biopsia. El cual se observa en fresco. Con tinta china con coloración de Giemsa. Se pude buscar el antígeno de Cryptococcus neoformans en sangre o en LCR. También se realizan cultivos. (20)
LESIONES EN LA MUCOSA BUCAL
Su reconocimiento clínico temprano, el correcto diagnóstico forma parte del seguimiento de las enfermedades de la boca y anexos asociados al SIDA. Desempeñan un papel importante en la estadificación de la infección por el HIV.
1-Micóticas:
- Candida spp.: Es la más común de las micosis oral, siendo C. albicans la especie mas habitualmente encontrada. Se desarrolla cuando descienden los linfocitos CD4 +. El diagnóstico se realiza encontrando filamentos del hongo en material de la lesión.
- Hystoplasma spp: Es una micosis profunda granulomatosa endémica. la histoplasmosis oral en pacientes HIV+ puede ser diagnóstico primario de SIDA
2-Virales:
- Epstein Barr. Se presenta como una lesión blanca de la lengua en formas de “parche”. En pacientes HIV+ su presencia indica progresión rápida a SIDA. El diagnóstico se realiza por hibridación, PCR o microscopía electrónica.
- Herpes simple. La lesión típica es la vesícula la cual se presenta en racimos o conglomerados. El diagnóstico se realiza por citología exfoliativa.
- Herpes humano-8:Esta relacionado con el Sarcoma de Kaposi. La lesión se instala preferentemente en los bordes del paladar y en la zona gingival. El diagnóstico debe confirmarse por biopsia.
- Papiloma humano (HPV): El condiloma acuminado es la lesión característica en la mucosa oral, siendo esta mas frecuente en pacientes con HIV. El diagnóstico se puede hacer4 por inmunohistoquímica, hibridación o PCR. (20)
INFECCIÓN DEL SISTEMA NERVIOSO CENTRAL
1-Meningitis Bacterianas:
El agente etiológico más frecuente es el Streptococcus pneumoniae,
cuya resistencia a penicilina es un problema cada vez más frecuente.
Otro germen menos frecuente e la Listeria monocytogenes. Mycobacterium
tuberculosis agente etiológico de meningitis crónica en
pacientes con SIDA. (22) (24)
Treponema pallidum ocasiona infecciones agudas o crónicas en el
paciente con SIDA. La respuesta serológica no siempre es confiable
por eso debe complementarse con :biopsias de lesiones cutáneas
, examen de campo oscuro o con IFD del material de lesión. Treponema
pallidum.
La coinfección de HIV con sífilis puede alterar la historia
natural de la sífilis tanto en su diagnóstico como en la
duración del tratamiento requerido para su curación. Además
la sífilis puede tener una evolución más rápida
por lo cual la punción de líquido cefalorraquídeo
asumiría gran importancia en estos pacientes.
Diagnóstico: La observación en campo oscuro o la coloración
de inmunofluorescencia directa de todo exudado de lesiones sospechosas
se debe realizar y posee valor diagnóstico aún en pacientes
con serología negativa. La detección del DNA treponémico
usando PCR está cobrando amplia difusión para le diagnóstico
de neurosífilis con resultados inciertos.
2- meningitis fúngicas:
Cryptococcus neoformans es el agente causal más frecuente en meningitis
en los pacientes con SIDA. Su aislamiento siempre indica infección
clínica o subclínica porque no forma parte de la flora normal.
También puede aislarse de otros sitios como: sangre, medula ósea,
pulmones, próstata suprarrenales y otros. El LCR es claro, con
poca cantidad de células, leve aumento de proteínas y moderada
a nula hipoglucorraquia. El diagnóstico se basa en la observación
del agente en fresco, o con tinta china. También puede detectarse
el antígeno al igual que cultivarse.
3-Encefalitis parasitarias:
Toxoplasma gondii: En los pacientes con SIDA la toxoplasmosis se manifiesta
frecuentemente como una encefalitis necrotizante. Debido a un defecto
en la inmunidad mediada por células se produce reactivación
de la infección latente que el riesgo es mayor cuando el recuento
de CD4 disminuye. Para el diagnostico la técnica de elección
es la PCR, dado que las técnicas inmunológicas no son de
utilidad en este caso.
En el laboratorio la demostración de inmunoglobulina G anti T
Gondii en el paciente con SIDA esta relacionado con el potencial desarrollo
de toxoplasmosis. Es necesario para distinguir entre infección
latente y reactivación la titulación de los anticuerpos
en dos muestras pareadas. En caso de detectar anticuerpos IgM se podría
asegurar una infección reciente. La IgA anti T Gondii se encuentran
raramente elevados en los pacientes con SIDA. La medición de IgE
anti T Gondii es de cierta utilidad en el paciente con SIDA ya que se
encuentra elevada en algunos pacientes con encefalitis toxoplásmica.
La detección del DNA por PCR es de relativa utilidad ya que su
presencia en el tejido cerebral persiste, aún en ausencia de enfermedad
actual.
Trypanosoma cruzzi: El chagoma cerebral es la manifestación mas
frecuente de la enfermedad de Chagas en el paciente con SIDA. El diagnóstico:
- 1)En la búsqueda del parásito por métodos: a)directos en sangre y en LCR. b) Indirectos: xenodiagnóstico y hemocultivos. c) Biopsia importante para determinar el diagnóstico de Chagomas cerebrales. E)detección de antígenos del protozoo en orina. f)PCR.
- 2) Estudios serológicos: utilizados en la etapa crónica Estos son: Hemaglutinación indirecta, Aglutinación directa, fijación de complemento IFI y ELISA.
- 3 Meningitis virales: Causadas por. Epstein barr, Poliomavirus JC, Enterovirus, Herpes y Arbovirus.
INFECCIONES DE LA SANGRE:
Bacteriemias:
El agente etiológico más frecuente en pacientes con SIDA
es el Rhodococcus equi Otros microorganismos son Enterococcus spp , Streptococcus
grupo viridans, Stomatococcus mucilaginossus.
Fungemias:
La investigación de hongos en hemocultivos ha tomado importancia
en los pacientes con HIV. Los más frecuentes aislados en SIDA son:
C. neoformans y H. capsulatum. La metodología usada ha avanzado
en las ultimas décadas. Los cuales comprenden:: Métodos
bifásicos, lisis-centrifugación con saponina y métodos
automatizados(BACTEC)
Micobacteriemias:
El cultivo de sangre para micobacteria comenzó a realizarse en
forma más frecuente a partir del advenimiento del SIDA. El hallazgo
de MAC se asocia con enfermedad avanzada de SIDA. También puede
hallarse M. tuberculosis.(23)
INFECCIONES RESPIRATORIAS BAJAS
Las infecciones por agentes oportunistas son causa importante de enfermedad
aguda y muerte en pacientes con enfermedad avanzada por HIV
Un de los microorganismos mas frecuentemente aislados es Pneumocystis
carinii cuya presencia indica un estadio avanzado de la enfermedad (25)
En el siguiente cuadro ( 1) se enumeran las múltiples etiologías
de la enfermedad pulmonar en los pacientes con HIV.
Las muestras pueden ser: Esputo, aspirado endotraqueal, lavado broncoalveolar,
biopsia transbronquial, cepillado con cepillo envainado, lavado bronquial,
biopsia de pulmón.
Pneumocystis carinii ha sido reconocido como causa de enfermedad en la
población inmunocomprometida. Desde 1981 el número de neumonías
por Pneumocystis carinii (PCP) fue incrementando paralelamente al aumento
de casos sintomáticos de infección por HIV; tal es así
que en los inicios de la epidemia en 1981, fue la enfermedad marcadora
en grupos de homosexuales y drogadependientes endovenosos.
A pesar de la imposibilidad de cultivar a este agente fuera de los modelos
animales, gracias a la aplicación de la biología molecular,
hoy se sabe que es un hongo.
Se conoce como fuente de infección la inhalación de la bacteria
a partir de un contacto cercano con portadores, los pacientes con conteos
inferiores de células CD4 tienen mayor riesgo para desarrollar
PCP.
El esputo inducido es efectivo para diagnosticar esta patología.
La muestra de elección, sin embargo es el lavado bronqueoalveolar
(BAL).
Su búsqueda se realiza por diferentes coloraciones. La sensibilidad
se incrementa mediante el empleo de técnicas de anticuerpo fluorescente.
Un resultado negativo en el BAL puede ser suficiente para excluir el diagnóstico
de PCP. (26)
Mycobacterium-avium Complex diseminado (MAC) es una infección emergente
muy común en el paciente con SIDA. La vía de invasión
puede ser gastrointestinal o respiratoria. El aislamiento de MAC en un
especimen respiratorio, precede frecuentemente la infección diseminada,
y por otro lado la presencia de micobacterias dentro de los macrófagos
en la pared intestinal sugeriría que el intestino sería
la puerta de entrada. En el SIDA, MAC causa una infección diseminada
con hemocultivos positivos.
Permanece aun desconocido si la diseminación de MAC resulta de
una nueva adquisición ambiental o si es una reactivación
de una infección latente. En el SIDA, la disfunción de los
macrófagos permite la supervivencia del MAC dentro de los mismos,
sumado a los bajos niveles de factor de necrosis tumoral, interferón
gama e interleuquina 2.
Diagnóstico: Técnicas de hemocultivo especiales para el
aislamiento de micobacterias, serían los métodos más
sensibles para el diagnóstico de la infección (casi del
100% de sensibilidad). El empleo de sondas de DNA específicas para
MAC, hace posible diferenciar en el término de horas la diferenciación
de MAC de otras micobacterias.
El diagnóstico histológico a partir de biopsias de nódulos
linfáticos, hígado o médula ósea presenta
la ventaja de arrojar resultados mucho antes que el cultivo de la sangre
(de 5 a 51 días). (21) (24)
La tuberculosis puede desarrollarse ya sea por una progresión directa
a partir de una infección recientemente adquirida o por la reactivación
de una infección latente. El riesgo de una progresión rápida
es mucho mayor en personas con HIV.
La inmunidad mediada por células, es el mecanismo predominante
mediante el cual la infección por tuberculosis se mantiene latente.
La coinfección con HIV induciría fracasos en el tratamiento
y aparición de cepas multiresistentes.
La tuberculosis tiende a ocurrir relativamente temprano en el curso de
la infección por HIV, aún con recuentos relativamente altos
de linfocitos CD4.
Diagnostico: Se realiza mediante la coloración de Ziehl Nielsen
y el cultivo de las muestras respiratorias. En algunos casos, sin embargo
es necesario realizar cultivos y coloraciones de materiales diferentes
tales como nódulos linfáticos, médula ósea,
orina o sangre. Con los métodos tradicionales se necesitan de seis
a diez semanas para la detección del desarrollo. Las técnicas
de cultivo radiométrico, o el empleo de sondas de DNA pueden acortar
este proceso a aproximadamente diez días. El empleo de la reacción
en cadena de la polimerasa (PCR) con su rapidez y alta especificidad resultan
de creciente aplicación, en la medida en que se emplean regiones
genómicas mas conservadas, que aumentan la sensibilidad de la técnica.
Las pruebas cutáneas de tuberculina pueden dar reacciones bajas
o ausentes en estos pacientes. Lo cual sería un indicador del estado
de la inmunidad mediada por células. (23) (24)
La infección por Citomegalovirus (CMV) es extremadamente común
en los pacientes con SIDA, en quienes causa enfermedades severas tales
como corioretinitis, esofagitis, colitis, neumonía, y severos desórdenes
neurológicos.
Virtualmente todos los pacientes con retinitis por CMV tienen recuentos
de células CD4 menores de cincuenta.
Diagnóstico: La serología puede ser de alguna utilidad,
obteniendo el titulo de IgG en dos muestras pareadas. También se
puede investigar IgM anti CMV para determinar infección reciente.
Las técnicas de biología molecular y de detección
de antígeno temprano (pp 65) en los monocitos constituyen el recurso
diagnóstico más rápido y efectivo para lograr un
diagnóstico certero y poder realizar un tratamiento oportuno. (20)
Cuadro 1
| Bacterias |
Hongos | Virus |
| Mycobacterium tuberculosis |
Pneumocystis carinii | Citomegalovirus |
| M.kansassii |
Cryptococcus neoformans | Herpes simple |
| Complejo M. avium |
Histoplasma capsulatum | Adenovirus |
| Streptococcus pneumoniae |
Coccidioides immitis | HIV |
| Haemophilus influenzae | Aspergillus fumigatus | Tumores |
| Estreptococos del grupo A |
Penicillium marneffei | Sarcoma de Kaposi |
| Staphylococcus aureus |
Blastomyces dermatitidis | Linfoma no Hodgkin |
| Moraxella catarrhalis |
Candida albicans | Neumonitis intersticial |
| Pseudomonas aeruginosa Enterobacteriaceae Nocardia asteroides Legionella pneumophila Rhodococcus equi |
BIBLIOGRAFIA:
1-Mandell,Douglas y Bennett. Enfermedades infecciosas. Principios y practica,1997;
Cuarta edición parte I.PAG
2-Gaines H, Von Sydow MA, Von Stedingk LV (1990).Inmunological changes
in primary HIV-1 infection.aids.4:995-999.
3-Gomez Carrillo, M, Mora , J, Russi, JC. Garantía de calidad en
el diagnostico serologíco de la infección de la inmunodeficiencia
humana, Organización Panamericana de la Salud.1995.
4-Coffin, John M, HIV viral dynamics; AIDS 1996,VOL(10) Suplemento 3 .575-583.
5-Mc Cutchan, Francine E, Salminen Mika O, Carr Jean K and Burke Donalds.HIV-1
genetyic diversity.AIDS.4.107-112.
6-Smith,MW.Constrasting genetic influence of CCR2 y CCR5 variants on HIV-1
infection and disease progression.Science.1997,277:959-965.
7-The Medical Management of AIDS.Sande-Volberding.Saunders 5ta edición.
8-Graziosi,C;Pantaleo G: Immunopathogenesis of HIV infection. AIDS res
and Human Retrovirus.1998,vol.14,supl 2.135-142.
9-Saag,Ms,Holodniy M, Kuritzkes DR, O´Brien,WA, Coombs R, Poscher,ME,
Jacobsen DM, Shaw GM, Richman DD, Volberding. HIV viral load markers in
clinical practice, Nature Medicine, June 1996Vol 2, numero 6,.
10-Muchinik,G,Bouzas,M,Zala C, .Carga viral. Su significado e implicancias
en el tratamiento y seguimiento del paciente con HIV. 1998,revista CA.DI.ME.
pag 20-40.
11- LotharT. Clinical Laboratory Diagnostics: Use and assessment of clinical
laboratory results, English edition, 1998.
12-Deluchi G, Ganizal A, Mangano, Bologna, Benettucci, Sen, .Aplicaciones
de la PCR anidada para el diagnostico de infección por el HIV-1
en pediatría, noviembre 1997,Vol 5 (18).282-287.
13-Rizzardi,GP,Pantaleo,G:CCR2 polimorphism and HIV disease. Nature Med.1998,4:252-253.
14-Henrard DR, Phillips JF, MuenzL R, et al .Natural history of HIV-1
cell-free viremia .JAMA,1995;274:554-558.
15-Saag Michael S. Use of virologic markers in clinical practice .Journal
of Acquired Immune Deficiency Síndromes and Human Retrovirology.1997 vol.
16 suple 1 S3-S13
16-Obrien WA, Hartigan PM, Martin D, et al .Changes in plasma HIV-1 RNA
and cd4+ limfphocyte counts and the risk of progression to AIDS-N Eng
J Med.1996;334:426-431.
17-Oficina de HIV/SIDA y enfermedades de transmisión sexual. Organización
Mundial de la Salud. GINEBRA. en colaboración con UNAAIDS, las
implicancias de los tratamientos antirretrovirales, Actualizaciones en
SIDA,1997.VOL 5 (18) 236-261.
18-Clotet,B,rUIZ l, Paredes, R. Resistencia primaria al HIV-1 .Actualizaciones
en el SIDA .vol. 7 (24) junio 1999.65-71.
19-Salomon H, Gómez Carrillo M, Pampuro S, Aunla M, Waimberg M.
Técnicas para evaluar la resistencia a drogas del virus de la inmunodeficiencia
humana tipo 1 (HIV).Actualizaciones en SIDA junio 1999,vol 7 (24) 72-77.
20-Infecciones en el paciente inmunocomprometido incluido SIDA. Asociación
Argentina de Microbiología. Modulo 19.enero 2000.
21-Chin DP Yajko DM, Hopenell PC, et al Mycobacterium avium complex in
the respiratory o gastrointestinal tract and the risk of Mycobacterium
avium complex bacteriemia in patients with HIV, 1994 J Infect Disease,169:289-295.
22-CDC:Cases of specified notificsable diseases. United States, 1992 MMWR
39: 944
23-Chin DP, Yajko DM, Hadleywk et al Clinical utility of a commercial
test based on PCR, for detection Mycobacterium Tuberculosis in respiratory
Specimen, Am 1995 J Respir Crit Care MED 151:1872-1877.
24-Bishburg E, Sunderamg. Central nervous system tuberculosis with AIDS
and its related complex .An Intern Med.1996 105-201.
25-Edman JC, Sogin ML:Molecular phylogenetics of P carinii.In Walger PD
eds PCP New York Marcel Dekker,Inc,1994.VOL 69 91-105.
26-Eisen D, Ross BC, Fairbairn J et al: Comparison P, Carinii detection
by toluidine blue o staining, DFA and DNA amplification in sputum specimen
form HIV positive patiens. 1996 AIDS 125-127.
27-Bosio J C, Troncoso R .Revista Argentina de Infectologia Diagnostico
molecular en enfermedades infecciosas.1996 VOL IX N 7