El mes pasado, Gytis Dudas estaba rastreando una nueva variante de preocupación del SARS-CoV-2 que había desencadenado un brote de COVID-19 en su Lituania natal y apareció esporádicamente en otras partes de Europa y Estados Unidos. Al explorar una base de datos internacional de genomas de coronavirus, Dudas encontró una pista crucial: una muestra de la nueva variante provino de una persona que había volado recientemente a Francia desde Camerún. Un colaborador, Guy Baele de KU Leuven, pronto identificó seis secuencias más de personas en Europa que habían viajado a Camerún. Pero luego su búsqueda para identificar los orígenes de la variante chocó contra una pared: Camerún había subido un total de solo 48 genomas al repositorio de secuencias global, llamado GISAID1. Ninguno incluyó la variante.
Con un trabajo de campo tenaz, Baele y Dudas, biólogo evolutivo del Centro de Biodiversidad Global de Göteborg, se enteraron de que otro equipo había recopilado secuencias aún no publicadas de un brote de COVID-19 en un centro de investigación de grandes simios en la República Centroafricana, cerca de la frontera con Camerún. Seis personas portaban la nueva variante.
Baele, Dudas y sus colegas reconstruyeron el árbol evolutivo y la distribución geográfica de la nueva variante, y concluyeron que probablemente surgió en Camerún. Señalan que la variante lleva una serie de mutaciones observadas en otras “variantes de preocupación” que son más infecciosas o peligrosas.
“Parecía la situación típica que debería hacer sonar todas las alarmas”, dijo Sebastien Calvignac-Spencer, un biólogo evolutivo del Instituto ‘Robert Koch’ cuyo equipo secuenció las muestras de la estación de simios. Pero Camerún y los países vecinos, donde el equipo infirió que la variante ya podría ser frecuente, no la detectaron.
Los investigadores dicen que la historia de esta variante, designada B.1.620, contiene una advertencia para el mundo: “El esfuerzo de secuenciación en Camerún y otros países africanos no es suficiente”, dice el coautor Ahidjo Ayouba, biólogo del Instituto Nacional Francés de Investigación para el Desarrollo Sostenible, de la Universidad de Montpellier. Viajará a su Camerún natal el próximo mes para configurar el primer secuenciador de próxima generación del país. La aparición de nuevas variantes con mutaciones deletéreas en países sin secuenciación regular “puede convertirse en una norma alarmante”, advirtieron los investigadores.
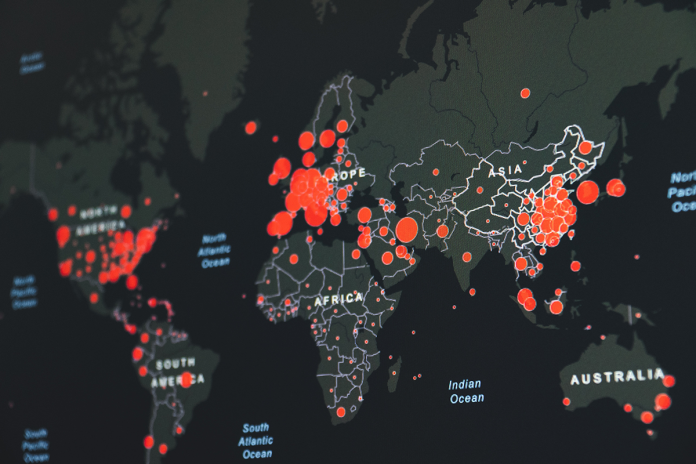
No es solo África. De los 152 países para los que se disponía de datos al 10 de mayo, 100 habían subido datos de secuencia de menos de 1% de los casos notificados a la GISAID. Entre ellos, 51 países, incluidas naciones grandes como India, Indonesia, Rusia y Brasil, habían subido secuencias para menos de 0,1% de los casos. Diez naciones ricas representaron 82% de las más de 1,4 millones de secuencias en la base de datos de la GISAID. “Estamos trabajando para cambiar eso”, dijo Frank Konings, líder del Grupo de Trabajo de Evolución del Virus de la Organización Mundial de la Salud (OMS).
La mayoría de los países con escasa secuenciación también tienen actualmente poco o ningún acceso a las vacunas, y algunos sufren brotes importantes. A medida que el virus se replica sin control, esas regiones pueden convertirse en caldo de cultivo para nuevas mutaciones, que luego pueden extenderse por todo el mundo. India, por ejemplo, se enfrenta al aumento de casos más grande del mundo. El 11 de mayo, la OMS etiquetó la nueva variante B.1.617, que surgió en India y se ha extendido a decenas de países, como variante de preocupación. “Donde la pandemia no está actualmente controlada es donde se puede esperar que las variantes estén aumentando”, dijo Dudas. “Sería mucho más interesante secuenciar los últimos 1.000 casos en la República Centroafricana que los próximos 100.000 casos en Alemania”.
A nivel mundial, los obstáculos para la vigilancia sistemática son abrumadores. Los secuenciadores de última generación cuestan 335.000 dólares y los científicos locales deben estar capacitados para usarlos. Muchas áreas carecen de las carreteras y la refrigeración necesarias para transportar rápidamente las muestras. En India, “el problema es el muestreo: alguien tiene que recolectar y enviar las muestras y proporcionar los datos clínicos. Eso toma su tiempo”, dijo Anurag Agrawal, director del Instituto de Genómica y Biología Integrativa del Consejo de Investigaciones Científicas e Industriales en New Delhi. Y es necesario importar continuamente los costosos reactivos de secuenciación.
“Pedimos reactivos de una empresa estadounidense en noviembre de 2020. ¡Y recién están llegando ahora!”, dijo Senjuti Saha, microbiólogo de la Fundación para la Investigación de la Salud Infantil en Dhaka, Bangladesh. “Esto no es una excepción: es la regla”.
No obstante, Saha estaba satisfecho con un esfuerzo de múltiples laboratorios que le ha permitido al país ampliar la secuenciación a 0,2% de los 777.000 casos identificados. “No creo que ese número sea muy bueno”, dijo. “Pero antes era cero. Y nunca antes habíamos hecho esto”.
El esfuerzo ya está dando sus frutos: recientemente, el 8 de mayo, se descubrió que dos pacientes de Bangladesh que habían regresado recientemente de India portaban la variante B.1.617. Dos días después, tras una larga reunión con científicos, los funcionarios de Bangladesh endurecieron la cuarentena en la frontera.
Otros países enfrentan desafíos geográficos. En diciembre de 2020, científicos brasileños identificaron la P.1, ahora una un variante de preocupación a nivel mundial, durante brote masivo en Manaus, la capital del estado de Amazonas. Pero la cobertura de secuenciación es pobre en lugares como el vecino estado de Acre, en la selva tropical, y en el noreste de Brasil, dice Ana Vasconcelos, bióloga computacional del Laboratorio Nacional de Computación Científica en Petrópolis, Brasil. Ella dice que solo se han cargado 25 genomas desde Acre. Ella reclutó a colegas allí para que proporcionaran 100 muestras, luego descubrió que no había hielo seco, necesario para el transporte. Finalmente recibió las muestras el 13 de mayo, con la ayuda de una organización no gubernamental francesa, la Fundación Mérieux.
Algunos expertos han sugerido que las naciones tengan como objetivo secuenciar el virus de 5% de los casos, pero otros dicen que esos objetivos están equivocados. “El mundo se está obsesionando demasiado con los números”, dijo Tulio de Oliveira, biólogo computacional y director de KRISP, la Plataforma de Secuenciación de Investigación e Innovación de KwaZulu-Natal en la Universidad de KwaZulu-Natal, Durban. Por ejemplo, él y sus colegas sudafricanos identificaron la variante de preocupación que se originó en Sudáfrica poco después de que surgiera, al muestrear estratégicamente las regiones que luchan contra los brotes en lugar de aumentar el muestreo de manera uniforme en todo el país.
De Oliveira y un gran equipo de otros científicos africanos ahora han convertido los escasos datos de secuencia en África en un panorama general de cómo ha evolucionado el virus dentro del continente. En un reciente trabajo, basado en casi 9.000 secuencias recopiladas en 33 países africanos, encontraron que el SARS-CoV-2 probablemente llegó a varios países africanos con viajeros, principalmente de Europa. Las restricciones de viaje inicialmente mantuvieron el conteo de casos bajo control. Pero luego, el virus evolucionó en varias variantes de preocupación. “Aunque distorsionados por el bajo número de muestras y los puntos ciegos, los hallazgos destacan que África no debe quedarse atrás en la respuesta a la pandemia mundial, de lo contrario podría convertirse en un caldo de cultivo para nuevas variantes”, escribieron los autores.
Eso es cierto en todo el mundo, dijo Calvignac-Spener. “Realmente no es posible que sigamos siendo tan egoístas con la vigilancia genómica, con las vacunas”, dice. “No es entender nuestros mejores intereses”.
Referencias:
- Iniciativa Global para Compartir Todos los Datos sobre Influenza (GISAID).